1ФГАОУ ВО «Российский университет дружбы народов», Миклухо-Маклая ул., 6, 117198 Москва, Российская Федерация; 2Офтальмологическое отделение ГБУЗ МО «Сходненская городская больница», Мичурина ул., 31 А, мкр. Сходня, городской округ Химки, 141420 Московская область, Российская Федерация.
Evaluation of safety and effectiveness of the reverse meridional cyclodialysis ab interno combined with implantation of a metallic implant in the supraciliary space in decreasing intraocular pressure in patients with glaucoma of different etiology.
- Kumar1,2, M.A. Frolov1, G.N. Dushina1,2, A.C. Shradqa1, A.I. Bezzabotnov2
1Peoples’ Friendship University of Russia, 6, Mikluho-Maklaya St., 117198 Moscow, Russian Federation; 2Ophthalmic unit of Skhodnya City Hospital, 31 А, Michurina St., Skhodnya, Khimki, 141420 Moscow province, Russian Federation.
Сведения об авторах:
д.м.н., профессор Кумар Винод (Kumar Vinod, Med.Sc.D., Prof.),
ORCID: 0000–0002–5489–4607
д.м.н., профессор Фролов Михаил Александрович (Frolov Mikhail Aleksandrovich, Med.Sc.D., Prof.),
ORCID: 0000–0002–9833–6236
Аспирант Шрадка Ахмад Салех Солиман (Shradqa Ahmad Saleh Soliman, postgraduate, M.D.),
ORCID: 0000-0001-5814-9041
к.м.н. Душина Галина Николаевна (Dushina Galina Nikolaevna, Ph.D.),
ORCID: 0000–0002–6243–1012
Врач-офтальмолог Беззаботнов Андрей Игоревич (Bezzabotnov Andrej Igorevich, postgraduate, M.D.).
ORCID: 0000–0002–5677–3649
Для корреспонденции. Профессор Кумар Винод, 141407, РФ, Московская область, г Химки, ул. Панфилова 4 - 680, E mail – Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript.; тел. 8-916-474-50-86.
Резюме.
Цель. Оценить безопасность и эффективность обратного меридионального циклодиализа (ОМЦ) ab interno с введением в супрацилиарное пространство металлического имплантата в снижении внутриглазного давления (ВГД) у пациентов с глаукомой различной этиологии.
Материал и методы. ОМЦ ab interno проведен у 51 пациента, из них в 30 случаях имплантирован металлический имплантат в циклодиализную щель (основная группа). Результаты оценены спустя 12 месяцев и сравнены с результатами ОМЦ без имплантата у 21 пациента (контрольная группа). ОМЦ проводили с помощью специального шпателя на 4-5 часах на глубину 5-6 мм, ширина щели 11°-12° окружности радужно-роговичного угла. Критериями оценки являлись: динамика ВГД, потребность в дополнительной гипотензивной терапии, повторном хирургическом вмешательстве и наличие осложнений. Полученные данные обработаны методом вариационной статистики.
Результаты. Среднее исходное ВГД в основной и контрольной группе составляло 28,8±4,7 мм рт.ст. и 30,2±7,2 мм рт.ст., спустя 12 месяцев, оно снизилось на 28,7±12,0% и 29,1±17,1% соответственно. Среднее число гипотензивных препаратов в основной и контрольной группе было 2,7±0,8 и 2,6±0,9 и сократилось до 1,1±0,9 и 0,8±0,9 соответственно. В контрольной группе всеобщий успех достигнут в 66,7% (полный успех - 28,6%, признанный – 38,1%), а в основной группе - в 93,3% (полный успех - 33,3%, признанный – 60,0%) (Р=0,03). По отношению к снижению ВГД, сокращению гипотензивных препаратов, и наличие интра- и послеоперационных осложнений статистически достоверного различия между группами не установлено. Однако, повторное оперативное вмешательство потребовалось в контрольной группе в 5 раз чаще чем в основной (33,3% vs 6,7%, р=3Е-05).
Заключение. Имплантация металлического имплантата при ОМЦ ab interno с целью поддержания циклодиализной щели в открытом состоянии безопасна, эффективна и существенно снижает необходимость повторных хирургических вмешательств.
Abstract
Aim: To evaluate the safety and effectiveness of reverse meridional cyclodialysis ab interno (RMC) with implantation of a metallic implant in the supraciliary space in decreasing intraocular pressure in glaucoma patients.
Material and methods: RMC ab interno was performed in 51 patients. Out of these a metallic implant was implanted in the supraciliary space in 30 patients (implant group). Twenty-one patients having RMC ab interno without implant were included as a control group. RMC was performed through a clear corneal incision with help of a special spatula. The ciliary body was dialyzed over two o'clock at 4-5 o'clock for a distance of 5-6 mm. The results were evaluated after 12 months. Adverse events, postoperative IOP changes, need for hypotensive medications and repeat surgery were evaluated. The results were analyzed using variational statistics.
Results. Baseline mean IOP in implant and control group was 28.8±4.7 mmHg and 30.2±7.2 mmHg, at 12 months it was decreased by 28.7±12.0% and 29.1±17.1% respectively. Baseline mean medication usage was 2.7±0.8 and 2.6±0.9 in respective groups and at 12 months it decreased to 1.1±0.9 and 0.8±0.9. In implant group overall success was 93.3% (complete success - 33.3% and partial success - 60.0%), where as in control group it was 66.7% (complete success - 28.6% and partial success - 38.1%) (Р=0,03). In relation to IOP change, medication usage and adverse events the difference between groups was not significant. Repeat surgery was required more frequently in control group - 5 times more than in implant group (33.3% vs 6.7%, P=3E-05).
Conclusion: Implantation of a metallic implant in supraciliary space to keep the cyclodialysis cleft open is safe and effective and substantially decreases the need for repeat surgery.
Ключевые слова: малоинвазивная хирургия глаукомы, глаукома, супрацилиарный металлический имплантат, обратный циклодиализ, циклодиализ ab interno, увеосклеральный путь оттока внутриглазной жидкости, внутриглазное давление.
Key words: minimally invasive glaucoma surgery, glaucoma, supraciliary metallic implant, reverse cyclodialysis, cyclodialysis ab interno, uveoscleral outflow of intraocular fluid, intraocular pressure.
Введение. Главным направлением в лечении глаукомы на сегодняшний день является снижение внутриглазного давления (ВГД) [1]. Давление цели может быть достигнуто как за счет подавления продукции внутриглазной жидкости (ВГЖ), так и за счет активации ее оттока. Снижение продукции ВГЖ, а также создание искусственных путей оттока, приводит дренажную систему глаза в состояние гипоперфузии, что больше стимулирует ее дистрофические изменения. Наиболее перспективным направлением развития хирургии глаукомы представляется активация оттока ВГЖ по естественным путям, к которым относится увеосклеральный путь [2, 3, 4, 5, 6]. Увеосклеральный путь в норме обеспечивает отток ВГЖ в 20-25%. Однако, при облитерации Шлеммова канала и дегенеративном процессе в трабекулярном аппарате, роль указанного пути существенно возрастает [7,8]. Предложенный Heine в 1905 г циклодиализ как первоначальная концепция направления жидкости в задний отдел глазного яблока с гипотензивной целью за счет создания прямого сообщения между передней камерой глаза, супрацилиарным и супрахориоидальным пространствами не утратила своей актуальности [9]. Циклодиализ, по данным многих офтальмохирургов, имеет кратковременный гипотензивный эффект из-за облитерации циклодиализной щели [9]. С целью предупреждения блокады, созданной циклодиализной щели, предложены различные роды дренажей [3, 5, 10, 11]. Такие операции выполняются доступом либо ab interno, что удобно сочетать с факоэмульсификацией катаракты (имплантат CyPass Micro-Stent, производства Transcend Medical, США; iStent Supra, производство Glaukos, США) или традиционным доступом с формированием склерального лоскута (Gold Shunt, производство SOLX, США, STARFlo, iSTAR Medical, Бельгия и Aquashunt – изготовитель OPKO Health Inc.,США) [10, 11, 12, 13], в связи с малой доступностью на рынке и часто возникающей обструкцией просвета, все они мало применяются в клинической практике. Нами сконструировано приспособление (имплантат) из ванадиевого сплава нержавеющей стали медицинского качества, для введения в супрацилиарное пространство.
Цель. Оценить безопасность и эффективность обратного меридионального циклодиализа (ОМЦ) ab interno с введением в супрацилиарное пространство металлического имплантата собственной конструкции в снижении ВГД у пациентов с глаукомой различной этиологии.
Материал и методы. В анализ включен 51 пациент (51 глаз) с глаукомой различной этиологии. Пациенты были разделены на две группы. Основная группа составила 30 пациентов (16 мужчин и 14 женщин, всего 30 глаз), контрольная группа – 21 пациент (10 мужчин, 11 женщин, всего 21 глаз), средний возраст составил 73,8±8,0 (от 62 до 87 лет) и 75,2±6,9 (от 63 до 87 лет) соответственно. Пациенты обеих групп были сопоставимы по полу, возрасту и стадии развития глаукомы (таб.1). В исследование были включены пациенты как с глаукомой, так и с сочетанной патологией (глаукома и катаракта). Ранее проведенная факоэмульсификация катаракты, а также ранее проведенная антиглаукомная операция (АГО) не являлись критериями исключения из исследования. Минимальный срок послеоперационного наблюдения – 1 год.
Полученные данные обработаны методом вариационной статистики с определением среднего значения, 95%-ый доверительного интервала (ДИ) и стандартного отклонения для каждой группы с оценкой критерия достоверности (р) по Стьюденту при парных сравнениях. Для статистической обработки данных использовалась программа Microsoft Office Excel 2007 и SPSS Statistics 17.0.
Всем пациентам проводили стандартное офтальмологическое обследование, такие как визометрия, тонометрия, биомикроскопия, офтальмоскопия, гониоскопия, ультразвуковая биомикроскопия, В-сканирование. Пациентам проводили аппланационную тонометрию по Маклакову, грузом 10,0 г. Состояние созданной циклодиализной щели оценивали при помощи однозеркальной гониолинзы и ультразвуковой биомикроскопии (УБМ), которые проводили с помощью прибора «Marvel B-scanwith UBM» (Appasamy medical equipments (P) ltd, Индия), с частотой датчика 50 МГц и 30 МГц, мощностью до 30 Дб.
Для сбора клинического материала получено разрешение Комитета по этике Медицинского института Российского университета дружбы народов (протокол №16 от 17 ноября 2016 г.).
Всем пациентам проводили ОМЦ ab interno по разработанной авторской методике (заявка на патент РФ № 2017118944 от 31.05.2017), которая заключалась в следующем: через роговичный разрез размером 2,4-2,75мм, в переднюю камеру вводили раствор карбахола 0,1%-0,2 мл (медикаментозное сужение зрачка). Далее, переднюю камеру заполняли вискоэластиком (раствор гиалуроновой кислоты 1,4%). Под контролем хирургической гониолинзы и с помощью специально разработанного шпателя (рис.1а, б) (патент РФ на полезную модель № 174382 от 11.10.2017) на 4-5 часах проводили меридиональное отслоение цилиарного тела от склеры на глубину 5-6 мм, ширина щели 11°-12° окружности радужно-роговичного угла. Далее проводили аспирацию вискоэластика, восстанавливали переднюю камеру сбалансированным солевым раствором. Для профилактики закрытия щели и геморрагии в переднюю камеру вводили пузырь стерильного воздуха. Операцию заканчивали герметизацией разрезов гидратацией стромы роговицы. В основной группе дополнительно вводили металлический имплантат собственной конструкции в созданную циклодиализную щель.

Рис 1а
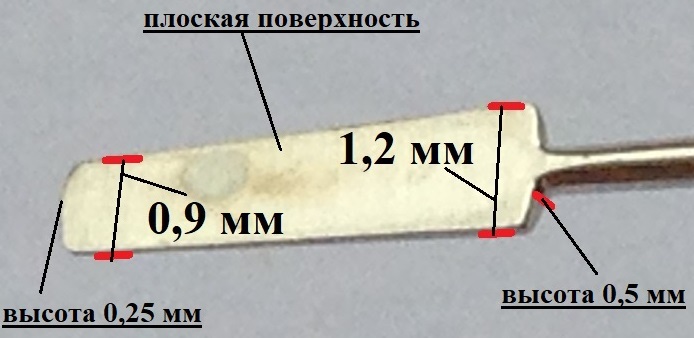
Рис 1б.
Имплантат имеет изогнутую U-образную форму, изготовлен из нержавеющей стальной проволоки (AISI 316L), диаметром 0,6 мм, длина – 6,5 мм и состоит из трех частей: две ножки и изгиб. В области ножек и изгиба имеются углубления (рис.2а, б). Расстояние между ножками 1-1,2 мм. Ось дренажа повторяет физиологические изгибы глазного яблока (патент РФ на полезную модель №175984 от 25.12.2017).

Рис 2а

Все операции выполнены в период с 11.2015 по 03.2017 г. Срок наблюдения составил более 1-ого года. Послеоперационное наблюдение проводили через 1 день, 1 неделю, 1, 3, 6 и 12 месяцев. Гониоскопию и измерение ВГД проводили при каждом визите пациента. Критериями оценки эффективности и безопасности проведенной операции являлись динамика ВГД, частота осложнений, характер циклодиализной щели, необходимость применения дополнительных гипотензивных средств и проведения повторного хирургического вмешательства.
Успешность проведенной операции оценивали согласно рекомендациям Всемирной глаукомной Ассоциации (World Glaucoma Association) [14]. Критериями оценки успеха являлись значение истинного ВГД (Р0) ≤ 21, 18, 15 и 12 мм рт.ст. и снижение ВГД не менее, чем на 20, 30, 40 и 40% от исходного в зависимости от стадий развития глаукомы (Ⅰ, Ⅱ, Ⅲ и Ⅳ соответственно), а также Р0 >6 мм р.ст.
Успех считался полным, если уровень ВГД удалось достигнуть без гипотензивных средств, признанный успех – на дополнительной гипотензивной терапии. Неудача – если уровень ВГД не удалось достигнуть и при необходимости в повторном хирургическом вмешательстве.
Для анализа тонометрическое ВГД переводили в Р0 используя таблицы Нестерова–Вургафта–Киселева–Таняшиной [15].
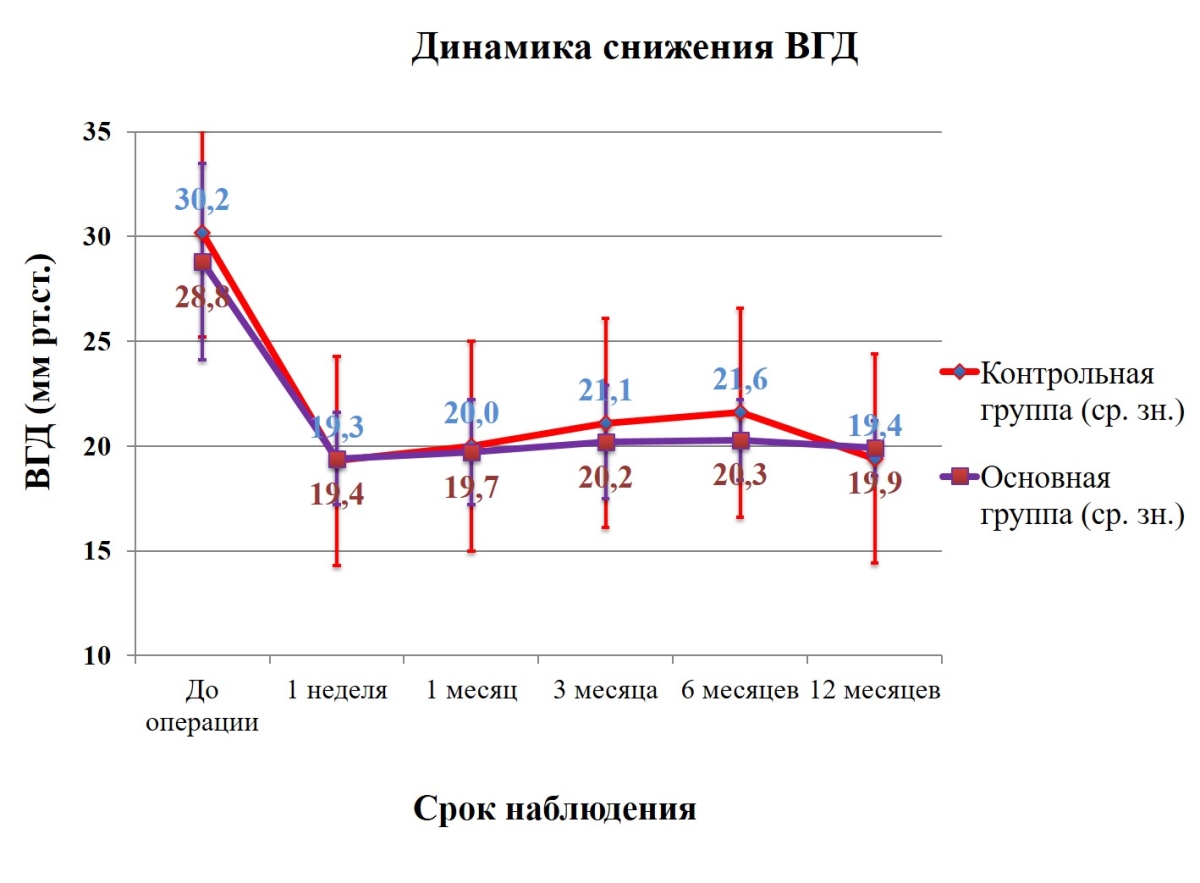
Результаты. Среднее ВГД до операции в основной и контрольной группе составляло 28,8±4,7 мм рт.ст. (95%-ый ДИ 26,6–30,3) и 30,2±7,2 мм рт.ст. (95%-ый ДИ 26,0-33,1) (p=0,44), среднее количество гипотензивных препаратов составило 2,7±0,8 (95%-ый ДИ 2,3-3,0) и 2,6±0,9 (95%-ый ДИ 2,1-2,9) (p=0,60) соответственно. Через 1 месяц после операции ВГД в основной группе снизилось на 30,6±10,5% от исходного и составило 19,7±2,5 мм рт.ст. (р=4E-12), через 3 месяца ВГД снизилось на 28,7±12,3% и составило 20,2±2,7 мм рт.ст.(р=4Е-10), через 6 месяцев после операции ВГД снизилось на 27,6±12,4% и составило 20,3±1,9 мм рт.ст.(р=7Е-10), а через 12 месяцев после операции ВГД снизилось на 28,7±12,0% от исходного и составило 19,9±1,3 мм рт.ст. (n=28, р=7Е-10). В контрольной группе через 1, 3, 6, 12 месяцев после операции ВГД снизилось на 30,7±16,3%, 26,9±18,8%, 25,2±17,2%, 29,1±17,1% от исходного и составило 20,0±2,8 мм рт.ст. (р=9Е-06), 21,1±3,6 мм рт.ст. (р=8Е-05), 21,6±5,0 мм рт.ст. (р=0,0006) и 19,4±1,5 мм рт.ст. (n=14, р=0,0006) соответственно. Анализ результатов показал, что статистически достоверная разница в снижении ВГД в обеих группах не зарегистрирована ни в один из периодов наблюдения (табл.2 и рис.3).
Рис 3.
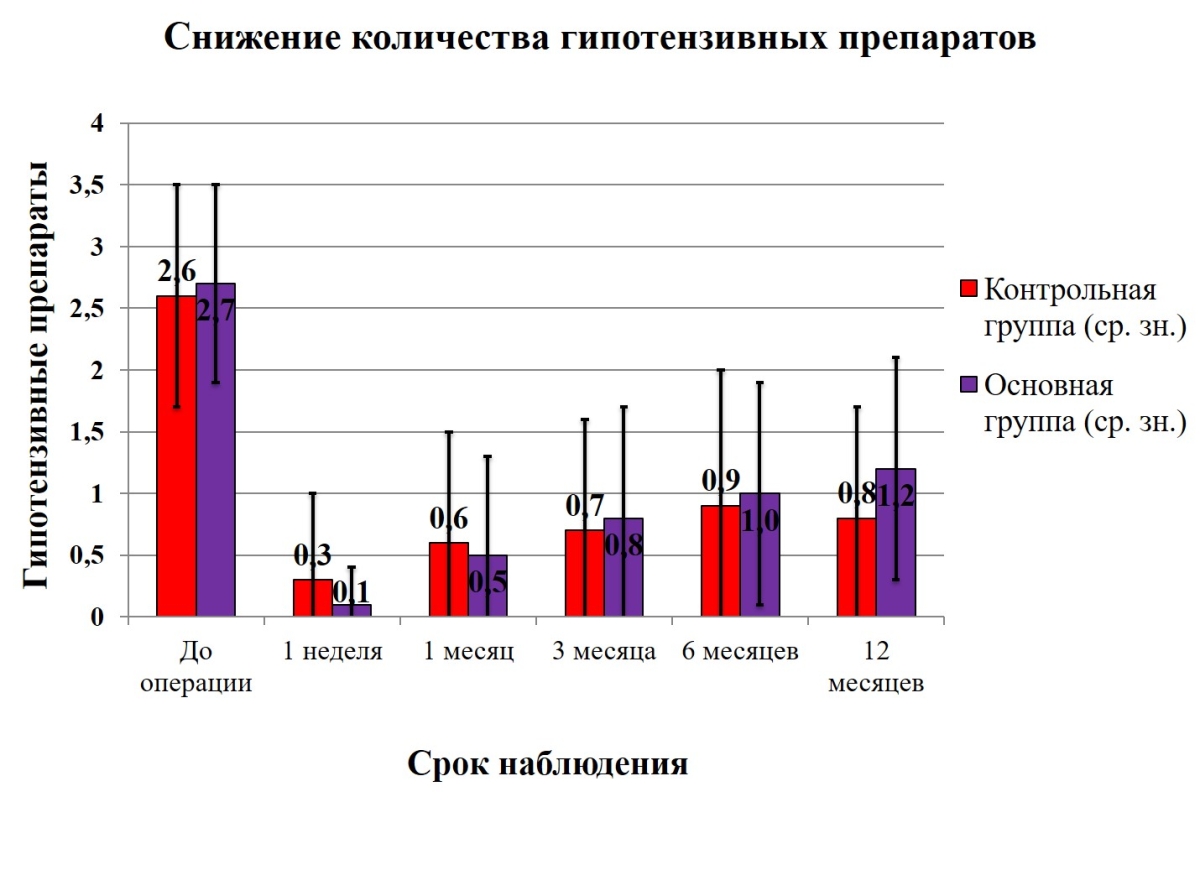
Через 12 месяцев после операции число гипотензивных препаратов снизилось до 1,1±0,9 (95%-ый ДИ 0,8-1,5) (n=28, р=4Е-07) в основной группе и 0,8±0,9 (95%-ый ДИ 0,3-1,3) (n=14, р=4Е-05) в контрольной группе. Достоверной разницы в уменьшении гипотензивных препаратов между группами не выявлено (p=0,24).
В таблице №3 приведены данные успеха. Из таблицы следует, что через 1 месяц после операции полный успех от операции в основной и контрольной группах достигнут в 66,7% и 61,9% случаев (р=0,67), признанный успех – в 33,3% и 33,3% (р=1,0), неудача – в 0,0% и 4,8% (р=0,03) соответственно. Через 3 месяца после операции полный успех достигнут в 56,7% и 61,9% случаев (р=0,63), признанный успех – в 43,3% и 19,1% (р=0,002), неудача – в 3,3% и 19,1% (р=0,001) в основной и контрольной группе соответственно. Через 6 месяцев после операции полный успех достигнут в 36,7% и 42,9% случаев (р=0,49), признанный успех – в 56,7% и 28,6% (р=0,002), неудача – в 6,7% и 33,3% (р=3Е-05) в основной и контрольной группе соответственно. Через 12 месяца после операции полный успех достигнут в 33,3% и 28,6% случаев (р=0,55), признанный успех – в 60,0% и 38,1% (р=0,03), неудача – в 6,7% и 33,3% (р=3Е-05) в основной и контрольной группе соответственно.
В течение всего срока наблюдения между группами не отмечено разницы в применении количества гипотензивных препаратов (табл.4 и рис.4). Во всех случаях признанного успеха была назначена инстиляционная гипотензивная терапия (0,005% латанопрост, 0,5% тимолол, 2% дорзоламид, 0,15% бримонидин и их комбинация) на фоне которой, ВГД снизилось до значений, не превышающих норму.
Рис 4.
В контрольной группе в 33,3% случаев (7/21) потребовалось проведение повторной АГО для компенсации ВГД. Повторное хирургическое вмешательство потребовалась через 1 месяц после операции в одном случае (1/7), через 3 месяца в трех случаях (3/7), а через 6 месяцев после операции в трех случаях (3/7). В этих случаях причиной неудачи была закупорка созданной циклодиализной щели. Двум пациентам (2/7) был проведен повторный ОМЦ ab interno с введением металлического имплантата. В результате, у 1-ого пациента ВГД нормализовалось (срок 1,5 года после операции ВГД 18 мм рт.ст. без применения гипотензивных препаратов). Второму пациенту понадобилось назначение гипотензивной терапии через 3 месяца после операции (срок наблюдение 1,5 года ВГД 20 мм. рт.ст. на режиме латанопрост 0,005%(.
В основной группе за весь срок наблюдения повторная АГО для компенсации ВГД потребовалась только в 6,7% случаях (2/30). По сравнению с контрольной группой, разница статистически достоверна (р=3Е-05). Успех после оперативного вмешательства в обеих группах иллюстрирован на кривых выживаемости Каплана–Мейера (Рис. 5).
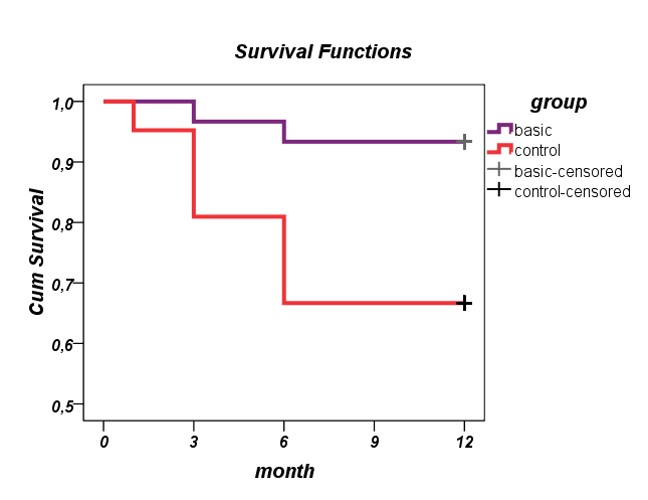
Рис 5.
Наиболее часто в раннем послеоперационном периоде наблюдали гифему, связанную с проведением циклодиализа. Данное осложнение встречалось у пациентов с далекозашедшей или развитой глаукомой и наблюдалось у пациентов с неоваскуляризацией угла передней камеры. В основной группе гифема встречалась в 28% случаев (9/30), в контрольной -в 38% случаев (8/21) соответственно. Разница между группами статистически недостоверна (Р=0,22). Во всех случаях гифема резобрировалась самостоятельно через 3-7 дней.
В основной группе осложнений в позднем послеоперационном периоде не наблюдали. По данным УБМ имплантат находился в созданной циклодиализной щели, смещения или полной дислокации не было отмечено ни в одном случае (рис.6).
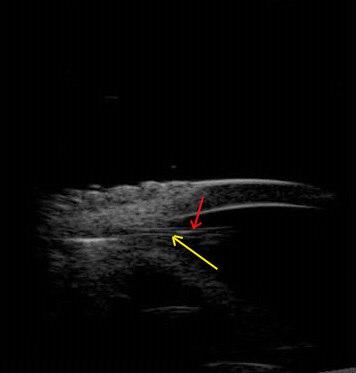
Рис 6.
В основной и контрольной группе в позднем послеоперационном периоде отмечали закрытие циклодиализной щели через 1 месяц в 0% и 10% случаев (Р=0,002), через 3 месяца в 7% и 33% случаев (Р=0,00004), через 6 месяцев в 13% и 48% случаев (Р=0,00001), а через 12 месяцев в 13% и 52% случаев (Р=1E-06) соответственно, разница статистически достоверна. Признаков воспалительной реакции не было отмечено ни в одном случае как в основной, так и в контрольной группах.
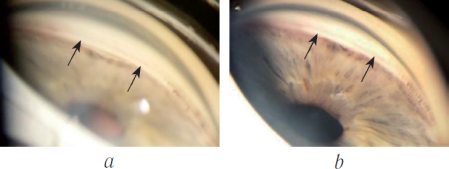
Для наглядности приводим пример клинического случая из практики. Клинический случай. Пациент А., мужчина 75 лет, поступил в глазное отделение с диагнозом рефрактерная оперированная открытоугольная глаукома Ⅲб, артифакия, псевдоэксфолитаивный синдром (ПЭС) правого глаза. Левый глаз – оперированная открытоугольная глаукома Ⅲа, артифакия, ПЭС. Пациент находился на следующем гипотензивном режиме: латанапрост 0,005% 1 раз на ночь, Бримонидин 2% и Тимолол 0,5% 2 раза в день в правый глаз, в левый глаз ничего не капал. Правый глаз – ВГД на гипотензивном режиме составляло 28 мм. рт.ст. (по Маклакову), левый глаз – ВГД составляло 20 мм. рт.ст. Объективные данные: оба глаза – угол передней камеры открыт, среднеширокий, пигментация умеренная. Диск зрительного нерва бледно-серый, экскавация 0,8 ДД. 16.12.2015 г. была проведена операция ОМЦ ab interno по вышеописанной методике. Пациента в послеоперационном периоде наблюдали ежедневно в стационаре, через 1 неделю, далее - ежемесячно. Измеряли ВГД, проводили гониоскопию. До 6 месяцев после операции ВГД варьировало от 20 мм рт.ст. при выписке до 25 мм рт.ст. К 6 месяцам наблюдали декомпенсацию ВГД. При гониоскопии выявили фиброз циклодиализной щели (Рис. 7а).
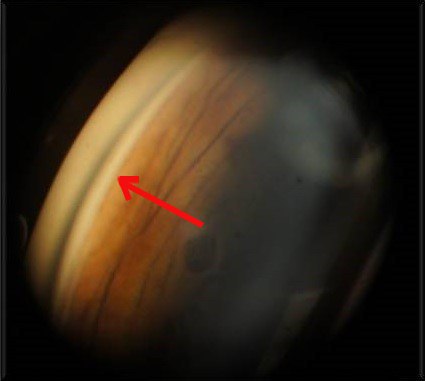
Рис 7а.
Назначили гипотензивную терапию - Латанапрост 0,005% 1 раз на ночь и Тимолол 0,5% 2 раза в день. ВГД на режиме - 26 мм рт.ст. Было принято решение о проведении повторного ОМЦ ab interno с введением металлического имплантата. 10.06.2016 г. проведено соответствующее вмешательство. После операции ВГД нормализовалось. Пациента наблюдали в течение 1 года. На весь срок наблюдения ВГД было в переделах нормы (18 мм рт.ст.) без гипотензивного режима. При гониоскопии определялась сохранная циклодиализная щель, имплантат находился в циклодиализной щели (Рис. 7б).

Рис 7б
Обсуждение. Циклодиализ в качестве гипотензивной операции при глаукоме применялся на протяжении нескольких десятков лет. Однако существенным недостатком данного вмешательства являлась нестойкость эффекта в связи с закрытием циклодиализной щели, поэтому дальнейшее развитие методики шло по пути разработки способов поддержания циклодиализной щели [2, 3, 5, 10, 11]. С этой целью были предложены различные роды дренажей, такие как CyPass Micro-Stent (Transcend Medical, США), iStent Supra (Glaukos, США), Gold Shunt (SOLX, США), STARFlo (iSTAR Medical, Бельгия) и Aquashunt (OPKO Health Inc., США)
Fiqus M. провёл имплантацию Gold Shunt 55 пациентам с рефрактерной глаукомой, за которыми наблюдал в течение 2-х лет после операции [16]. По данным автора, стабилизация ВГД с использованием гипотензивных препаратов отмечена в 67,3% случаев, только у 3 пациентов (5,5%) удалось компенсировать ВГД без дополнительных инстилляций. В послеоперационном периоде имело место такие осложнении, как цилиохориоидальная отслойка, отек роговицы и чрезмерная фильтрация. Главным фактором, определившим недостаточную эффективность имплантации шунта, автор называет формирование тонкой фиброзной мембраны, обтурирующей передний конец дренажного устройства.
Hueber A., проанализировав результаты имплантации Gold Shunt+ в супрацилиарное пространство у 31 пациента с некомпенсированным ВГД на фоне далеко зашедшей глаукомы, пришел к выводу о неэффективности данной методики дренирования, поскольку 24 (77%) пациентам потребовалось повторное гипотензивное вмешательство в результате повторного повышения ВГД [17].
Hoeh H. сообщил о высокой безопасности и достаточной гипотензивной эффективности комбинированной операции факоэмульсивикации катаракта с имплантацией CyPass Micro-Stent, где среднее ВГД снизилось всего лишь на 14% от исходного через 12 месяцев после операции [18]. Автор сообщает о таких осложнениях, как временная гипотония, транзиторное повышение ВГД и обструкция просвета.
Результаты клинических исследований Aquashunt и iStent Supra представленные в единичных докладах, до настоящего времени широко не опубликованы.
В 2014 году впервые был имплантирован силиконовый дренаж с микропорами StarFlo, однако результаты вмешательств в отдаленные сроки прослежены у небольшого количества пациентов, как правило, не сравнивались с другими типами хирургии, и были представлены только в единичных публикациях [5, 13].
Представленный нами металлический имплантат изготовлен из нержавеющей стальной проволоки медицинского качества и по биологической инертности никак не уступает золотому дренажу. Безопасность и биологическая инертность медицинских изделий, изготовленных из нержавеющей стали для применения в офтальмологии доказаны экспериментально [19] и на большом клиническом материале [20], что послужило толчком к разработке и применению данного имплантата.
Через 12 месяцев после ОМЦ с введением металлического имплантата полный успех достигнут в 33,3% случаев, признанный успех – в 60,0%, неудача – в 6,7% случаев, что доказывает высокую эффективность применения данного имплантата в снижении ВГД. Среднее ВГД снизилось на 28,7±12% от исходного и составило 19,9±1,3 мм рт. ст. (р=7Е-10).
Немаловажным достоинством металлического имплантата из медицинской нержавеющей стали является простота его конструкции, легкость имплантации, а также невысокая стоимость.
Закрытие циклодиализной щели в нашем исследовании отмечено только в 13% случаев, что указывает на высокую эффективности данного имплантата в подержания циклодиализной щели в открытом состоянии.
За весь период послеоперационного наблюдения эксплантация данного устройства вследствие воспалительной реакции или по другим причинам не потребовалась ни в одном случае. Мы также не наблюдали дислокацию данного приспособления. Все это указывает на безопасность применения данного имплантата в хирургии глаукомы.
Таким образом, можно достоверно говорить о целесообразности использования представленного имплантата в хирургическом лечении глаукомы различной этиологии, а также, базируясь на полученных результатах, можно рекомендовать данный имплантат для внедрения в широкую клиническую практику.
Заключение. Применение металлического имплантата достоверно и эффективно снижает ВГД от исходного. Данное устройство поддерживает циклодиализную щель в открытом состоянии, что существенно снижает необходимость повторных хирургических вмешательств.
Таблица 1. Распределение пациентов по возрасту, полу и по стадиям развития глаукомы.
|
Наименование |
Контрольная группа |
Основная группа |
Р |
|
Всего |
21 чел. |
30 чел. |
0,70 |
|
Мужчины |
10 чел. |
16 чел. |
|
|
Женщины |
11 чел. |
14 чел. |
|
|
Возраст (лет) |
75,2 ± 6,9 |
73,8± 8,0 |
0,44 |
|
Правый глаз |
11 глаз |
16 глаз |
0,95 |
|
Левый глаз |
10 глаз |
14 глаз |
|
|
Пациенты с глаукомой без сочетанной патологии |
13 |
15 |
0,41 |
|
Пациенты с сочетанной патологией |
8 |
15 |
|
|
Пациенты ранее оперированные по поводу глаукомы |
13 |
23 |
0,28 |
|
Стадии глаукомы |
0,49 |
||
|
2ст. |
9 глаз |
8 глаз |
|
|
3ст. |
4 глаза |
12 глаз |
|
|
4ст. |
8 глаз |
12 глаз |
|
Таблица 2. Динамика снижения ВГД после ОМЦ.
|
Срок наблюдения |
Контрольная группа |
Основная группа |
P |
||
|
ВГД, мм рт.ст. (ср.зн.± станд. отк.) |
Снижение ВГД (%) (ср.зн.±станд. отк.) |
ВГД, мм рт.ст. (ср.зн ±станд. отк.) |
Снижение ВГД (%) (ср.зн.±станд. отк.) |
||
|
До операции |
30,2±7,2 |
- |
28,8±4,7 |
- |
0,44 |
|
1 день |
20,0±3,2 |
30,4 ± 15,0 |
19,0±1,7 |
32,5 ± 11,3 |
0,76 |
|
1 недель |
19,3±2,9 |
33,4 ± 15,2 |
19,4±2,2 |
31,0 ± 13,2 |
0,55 |
|
1 месяц |
20,0±2,8 |
30,7 ± 16,3 |
19,7±2,5 |
30,6 ± 10,5 |
1,0 |
|
3 месяца |
21,1±3,6 |
26,9 ± 18,8 |
20,2±2,7 |
28,7 ± 12,3 |
0,70 |
|
6 месяцев |
21,6±5,0 |
25,2 ± 17,2 |
20,3±1,9 |
27,6 ± 12,4 |
0,39 |
|
12 месяцев |
19,4±1,5 |
29,1 ± 17,1 |
19,9±1,3 |
28,7 ± 12,0 |
0,93 |
где, ср.зн. – среднее значение, станд. отк. – стандартное отклонение, n - Количество пациентов.
Таблица 3. Успех выполненного ОМЦ.
|
Срок наблюдения |
Польный успех |
Признанный успех |
Неудача |
||||||
|
Контрольная группа, n (%) |
Основная группа, n (%) |
P |
Контрольная группа, n (%) |
Основная группа n (%) |
P |
Контрольная группа, n (%) |
Основная группа, n (%) |
P |
|
|
1 день |
20 (95,2) |
30 (100) |
0,73 |
1 (4,8) |
0 |
0,03 |
0 |
0 |
- |
|
1 недель |
17 (81) |
28 (93,3) |
0,35 |
4 (19,1) |
2 (6,7) |
0,01 |
0 |
0 |
- |
|
1 месяц |
13 (61,9) |
20 (66,7) |
0,67 |
7 (33,3) |
10 (33,3) |
1,0 |
1 (4,8) |
0 |
0,03 |
|
3 месяца |
13 (61,9) |
17 (56,7) |
0,63 |
4 (19,1) |
13 (43,3) |
0,002 |
4 (19,1) |
1 (3,3) |
0,001 |
|
6 месяцев |
9 (42,9) |
11 (36,7) |
0,49 |
6 (28,6) |
17 (56,7) |
0,002 |
7 (33,3) |
2 (6,7) |
3E-05 |
|
12 месяцев |
6 (28,6) |
10 (33,3) |
0,55 |
8 (38,1) |
18 (60) |
0,03 |
7 (33,3) |
2 (6,7) |
3E-05 |
Где, n - Количество пациентов
Таблица 4. Среднее число гипотензивных средств.
|
Срок наблюдения |
Контрольная группа |
Основная группа |
P |
||
|
n |
(ср.зн. ±станд. отк.) |
n |
(ср.зн. ±станд. отк.) |
||
|
До операции |
21 |
2,6± 0,9 |
30 |
2,7± 0,8 |
0,60 |
|
1 день |
21 |
0,1± 0,4 |
30 |
0 |
0,33 |
|
1 недель |
21 |
0,3 ± 0,7 |
30 |
0,1 ± 0,3 |
0,12 |
|
1 месяц |
21 |
0,6 ± 0,9 |
30 |
0,5 ± 0,8 |
0,72 |
|
3 месяца |
20 |
0,7 ± 0,9 |
30 |
0,8 ± 0,9 |
0,79 |
|
6 месяцев |
18 |
0,9 ± 1,1 |
29 |
1,0 ± 0,9 |
0,64 |
|
12 месяцев |
14 |
0,8 ± 0,9 |
28 |
1,1 ± 0,9 |
0,24 |
где, ср.зн. – среднее значение, станд. отк. – стандартное отклонение.
Список литературы (References.)
- Национальное руководство по глаукоме: для практикующих врачей, 3-е издание, исправленное и дополнение. Под ред. Егоров Е.А., Астахов Ю.С., Еричев В.П. М.: Издательство ГЭОТАР-Медиа; 2015. [Natsional'noe rukovodstvo po glaukome: dlya praktikuyushchikh vrachei, 3-e izdanie, ispravlennoe i dopolnenie. Pod red. Egorov E.A., Astakhov Yu.S., Erichev V.P. M.: Izdatel'stvo GEOTAR-Media; 2015. (In Russ.).]
- Фролов М. А., Фролов А. М., Казакова К. А. Комбинированные методы лечения при сочетании катаракты и глаукомы. Вестник офтальмологии. 2017;133(4):42–46. [Frolov M. A., Frolov A. M., Kazakova K. A. Combination treatment for cataract and glaucoma. Vestnik oftal'mologii. 2017;133(4):42–46. (In Russ.).] https://doi.org/10.17116/oftalma2017133442-46
- Петров С.Ю., Вострухин С.В., Асламазова А.Э., Шерстнева Л.В. Современная микроинвазивная хирургия глауком. Вестник офтальмологии. 2016;132(3):96–102. [Petrov S.YU., Vostrukhini S.V., Aslamazova A.E., Sherstneva L.V. Modern methods of minimally invasive glaucoma surgery. Vestnik oftal'mologii. 2016;132(3):96–102. (In Russ.).] http://dx.doi.org/10.17116/oftalma2016132396-102
- Калижникова Е.А., Лебедев О.И., Козаченко Г.М., Булгакова В.А., Атаманенко А.А. Активация увеосклерального оттока при факоэмульсификации катаракты у пациентов с первичной глаукомой. Новости глаукомы. 2016;1:104–107. [Kalizhnikova E.A., Lebedev O.I., Kozachenko G.M., Bulgakova V.A., Atamanenko A.A. Activation uveoscleral outflow during phacoemulsification cataract patients with primary glaucoma. Novosti glaukomy. 2016;1:104–107. (In Russ.).]
- Kammer JA, Mundy KM. Suprachoroidal Devices in Glaucoma Surgery. Middle East Afr J Ophthalmol. 2015;22(1):45– https://doi.org/10.4103/0974-9233.148348
- Карлова Е.В. Хирургическая активация увеосклерального оттока при глаукоме. Национальный журнал глаукомы. 2014;3:77–87. [Karlova E.V. Surgical activation of uveoscleral outflow in glaucoma patients. Natsional'nyi zhurnal glaukomy. Natsional'nyi zhurnal glaukomy. 2014;3:77–87. (In Russ.).]
- Ставицкая Т.В. Увеосклеральный отток и его роль в регуляции офтальмотонуса. Клиническая офтальмология. 2000;1:19–21. [Stavitskaya T.V. Uveoscleral outflow and it’s role in ophthalmotonus regulation. Klinicheskaya oftal'mologiya. 2000;1:19–21. (In Russ.).]
- Столяров Г.М., Тихомирова Н.В., Тихомиров И.В. Метод количественной оценки увеосклерального оттока для оптимизации лечения глаукомы. Вестник офтальмологии. 2016;132(3):10-14. [Stolyarov M.,Tikhomirova N.V., Tikhomirov I.V. Quantitative evaluation of uveoscleral outflow for optimization of glaucoma treatment. Vestnik oftal'mologii. 2016;132(3):10-14. (In Russ.).] https://doi.org/10.17116/oftalma2016132310-14
- Мамиконян В.Р., Петров С.Ю., Карлова Е.В. Сафонова Д.М., Циклодиализ в лечении глаукомы. История и современность. Национальный журнал глаукомы. 2015;14(1):76–83. [Mamikonyan V.R., Petrov S.Yu., Karlova E.V. Safonova D.M. Cyclodialysis in the treatment of glaucoma. Past and present. Natsional'nyi zhurnal glaukomy. 2015;14(1):76–83. (In Russ.).]
- Gigon A, Shaarawy T. The SuprachoroidalRoute in Glaucoma Surgery. J Curr Glaucoma 2016;10(1):13–20. https://doi.org/10.5005/jp-journals-10008-1197
- Hoeh H, Ahmed II, Grisanti S, Grisanti S, Grabner G, Nquyen QH, Rau M, Yoo S, Ianchulev N. Early postoperative safety and surgical outcomes after implantation of a suprachoroidal micro-stent for the treatment of open-angle glaucoma concomitant with cataract surgery. J Cataract Refract. Surg. 2013;39 (3): 431–437. https://doi.org/10.1016/j.jcrs.2012.10.040
- Hueber A, Roters S, Jordan JF, Konen W. Retrospective analysis of the success and safety of Gold Micro Shunt Implantation in glaucoma. BMC Ophthalmology. 2013;13:35. https://doi.org/10.1186/1471-2415-13-35
- Pourjavan S, Collignon N, De Groot V. STARFlo Glaucoma Implant: 12 month clinical results. Acta Ophthalmologica. 2013;91:252. https://doi.org/10.1111/j.1755-3768.2013.3723.x
- Shaarawy TM, Sherwood MB, Grehn F, eds. Guidelines on design and reporting of glaucoma surgical trials. World Glaucoma Association. Amsterdam: Kugler publications; 2008, 2009.
- Краснов М.М. Микрохирургия глауком, 2-е издание. М.: Медицина; 1980. [Krasnov M.M. Mikrokhirurgiya glaukom, 2-e izdanie. : Meditsina; 1980. (In Russ.).]
- Figus M, Lazzeri S, Fogagnolo P, Laster M, Martinelli P, Nardi M. Supraciliary shunt in refractory glaucoma. Br J Ophthalmol. 2011; 95(11): 1537-41. https://doi.org/10.1136/bjophthalmol-2011-300308
- Hueber A, Roters S, Jordan JF, Konen W. Retrospective analysis of the success and safety of Gold Micro Shunt Implantation in glaucoma. BMC Ophthalmol. 2013;13:35. https://doi.org/10.1186/1471-2415-13-35
- Hoeh H, Vold SD, Ahmed IK, Anton A, Rau M, Singh K, Chang DF, Shingleton BJ, Ianchulev T. Initial Clinical Experience With the CyPass Micro-Stent: Safety and Surgical Outcomes of a Novel Supraciliary Microstent. J Glaucoma. 2016;25(1):106–112. https://doi.org/10.1097/ijg.0000000000000134
- Rijneveld WJ, Jongebloed WL, Worst JG, Houtman WA. Comparison of the reaction of the cornea to nylon and stainless steel sutures: an animal study. Doc Ophthalmol. 1989;72(3):297– https://doi.org/10.1007/bf00153497
- Кумар В., Душин Н.В. Клинический опыт применения металлического шва в микрохирургии глаза. Вестник офтальмологии. 2003;5:16–20. [Kumar V., Dushin N.V. Clinical experience with metal seam in microsurgery of the eye. Vestnik oftal'mologii. 2003;5:16-20. (In Russ.).]
- Рисунок 1. Офтальмологический шпатель для циклодиализа. 1а - рабочая часть вид сверху, размеры указаны на рисунке, 1б - кончик рабочей части вид снизу, размеры указаны на рисунке.
- Рисунок 2. Супрацилиарный металлический имплантат из нержавеющей ванадиевой стальной проволоки. 2а - вид сверху, в области ножек имеются углубления, 2б - вид снизу, имеется углубление в области изгиба.
- Рисунок 3. Графическое изображение динамики снижения ВГД после операции у пациентов обеих групп.
- Рисунок 4. Графическое изображение снижения количества гипотензивных препаратов, применяемых пациентами после операции в различные сроки наблюдения.
- Рисунок 5. Кривые выживаемости Каплана – Мейера. Для оценки вероятности успеха гипотензивной операции у пациентов основной (фиолетовый) и контрольной (красный) групп.
- Рисунок 6. Ультразвуковая биомикроскопия. Имплантат (красная стрелка) находится в циклодиализной щели. Сохранная циклодиализная щель (желтая стрелка) между ножками имплантата. Срок наблюдения - 1 год после операции.
- Рисунок 7. Гониоскопическое изображение угла передней камеры. 7а - после ОМЦ без введения имплантата. Циклодиализная щель закрылась в результате фиброза. Срок наблюдение - 6 месяцев. 7б - после ОМЦ с введением в циклодиализную щель металлического имплантата. Хорошо определяется сохранная циклодиализная щель между двумя ножками имплантата. Срок наблюдения -1 год после введения имплантата.
В. Кумар, М.А. Фролов, Г.Н. Душина, А.С. Шрадка, А.И. Беззаботнов
Участие авторов:
Концепция и дизайн исследования: В.К., А.Ш., Г.Д., А.Б.
Сбор и обработка материала: А.Ш.
Статистическая обработка: А.Ш.
Написание текста: А.Ш., В.К., Г.Д.
Редактирование: М.Ф., В.К.